- Как рассчитать эффективный заряд ядра — Наука — 2021
- TL; DR (слишком долго; не читал)
- Найти Z: атомный номер
- Найти S: Правила Слейтера
- Найти S: назначить электронные значения
- Найти S: добавить значения вместе
- Вычтите S из Z
- Как рассчитать заряд иона
- Как рассчитать формальный заряд cocl2
- Как рассчитать эффективный заряд атома
- 1.2.3. Кристаллоструктурный метод расчета ионности связей и эффективных зарядов атомов в минералах
Как рассчитать эффективный заряд ядра — Наука — 2021
Эффективный заряд ядра относится к заряду, ощущаемому внешними (валентными) электронами многоэлектронного атома после учета количества экранирующих электронов, окружающих ядро. Формула для расчета эффективного заряда ядра для одного электрона имеет вид «Zeff = Z — S», где Zeff — эффективный заряд ядра, Z — число протонов в ядре, а S — среднее количество электронной плотности между ядро и электрон, для которого вы решаете.
В качестве примера, вы можете использовать эту формулу, чтобы найти эффективный заряд ядра для электрона в литии, в частности, электрона «2s».
TL; DR (слишком долго; не читал)
Расчет эффективного заряда ядра: Zeff = Z — S. Zeff — эффективный заряд, Z — атомный номер, а S — величина заряда из правил Слейтера.
Найти Z: атомный номер
Определите значение Z. Z — число протонов в ядре атома, которое определяет положительный заряд ядра. Число протонов в ядре атома также известно как атомный номер, который можно найти в периодической таблице элементов.
В этом примере значение Z для лития равно 3.
Найти S: Правила Слейтера
Найдите значение S, используя правила Слейтера, которые предоставляют числовые значения для концепции эффективного заряда ядра. Это может быть достигнуто путем записи электронной конфигурации элемента в следующем порядке и группировках: (1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d), (4f), ( 5s, 5p), (5d), (5f) и т. Д. Числа в этой конфигурации соответствуют уровню оболочки электронов в атоме (насколько далеко электроны от ядра), а буквы соответствуют заданной форме орбиты электрона. Проще говоря, «s» представляет собой сферическую орбитальную форму, «p» напоминает фигуру 8 с двумя лепестками, «d» напоминает фигуру 8 с пончиком вокруг центра, а «f» напоминает две фигуры 8, которые разделяют друг друга,
В этом примере у лития есть три электрона, и электронная конфигурация выглядит следующим образом: (1s) 2, (2s) 1, что означает, что на первом уровне оболочки находятся два электрона, оба со сферическими орбитальными формами, и один электрон (фокус этот пример) на втором уровне оболочки, также со сферической формой.
Найти S: назначить электронные значения
Назначьте значение электронам в соответствии с их уровнем оболочки и формой орбиты. Электроны на орбите «s» или «p» в той же оболочке, что и электрон, для которого вы решаете, дают 0, 35, электроны на орбите «s» или «p» в оболочке на один энергетический уровень ниже, дают 0, 85, а электроны на орбите «s» или «p» в оболочках два энергетических уровня и нижний дают вклад 1. Электроны на орбите «d» или «f» в той же оболочке, что и электрон, для которого вы рассчитываете, дают 0, 35, а электроны в орбита «d» или «f» на всех более низких энергетических уровнях вносит вклад 1. Электроны в оболочках выше, чем электрон, для которого вы решаете, не способствуют экранированию.
В этом примере в оболочке есть два электрона, которые на один энергетический уровень ниже, чем оболочка электрона, для которого вы решаете, и у них обоих есть «s» орбитали. Согласно правилам Слейтера, каждый из этих двух электронов вносит 0, 85. Не включайте значение для электрона, для которого вы решаете.
Найти S: добавить значения вместе
Рассчитайте значение S, сложив числа, которые вы присвоили каждому электрону, используя правила Слейтера.
В нашем примере S равно 0, 85 + 0, 85 или 1, 7 (сумма значений двух электронов, которые мы считаем)
Вычтите S из Z
Вычтите S из Z, чтобы найти эффективный заряд ядра, Зефф.
В примере с использованием атома лития Z равно 3 (атомный номер лития), а S равно 1, 7. Изменяя переменные в формуле на правильные значения для примера, он становится Zeff = 3 — 1.7. Значение Zeff (и, следовательно, эффективный заряд ядра 2s-электрона в атоме лития) составляет 1, 3.
Как рассчитать заряд иона
Чтобы рассчитать заряд иона, вычитая число или электроны из числа протонов в атоме.
Как рассчитать формальный заряд cocl2
При определении формального заряда молекулы, такой как CoCl2 (газ фосген), необходимо знать число валентных электронов для каждого атома и структуру молекулы Льюиса.
Источник
Как рассчитать эффективный заряд атома
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА, характеризует разность между числом электронов, принадлежащих данному атому в химический соединение, и числом электронов свободный атома. Для оценок ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА з. а. используют модели, в которых экспериментально определяемые величины представляют как функции точечных неполяризуемых зарядов, локализованных на атомах; например, дипольный момент двухатомной молекулы рассматривают как произведение ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА з. а. на межатомное расстояние. В рамках подобных моделей ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА з. а. можно рассчитать, используя данные оптический или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в химический соединение делокализована и границ между атомами не существует, нельзя описать различные характеристики соединение одним набором Э. з. а.; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА з. а. можно определить также на основе квантовохимический расчетов.
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА з. а., определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физических-химический характеристиками соединение, установления реакционное центров в молекулах, оценки степени ионности химической связи.
Литература: Баринский Р. Л., Нефедов В. И., Рентгеноспектральное определение заряда атомов в молекулах, М., 1966.
Химическая энциклопедия. Том 5 >> К списку статей
Источник
1.2.3. Кристаллоструктурный метод расчета ионности связей и эффективных зарядов атомов в минералах
Этот метод базируется на двух основных постулатах: Химическая связь, осуществляемая связывающими межостовными электронами, рассматривается как взаимодействие ближнего порядка (ковалентного типа), оно происходит на расстояниях, отвечающих сумме ковалентных радиусов атомов. Иными словами, предполагается, что перераспределение электронной плотности в соединении между атомами происходит в пределах их первых координационных сфер, определяемых координационными числами (КЧ) атомов. В химических соединениях имеет место тенденция реализации электронейтрального состояния атомов. В рамках остовно-электронного подхода это означает стремление остовов к присоединению связывающих электронов с целью реализации состояния нейтральных атомов, поскольку процесс рекомбинации электронов экзотермичен. Другое дело, что разные остовы, обладая неодинаковыми силовыми характеристиками, в различной степени способны реализовать эту тенденцию, благодаря чему и получается то или иное распределение эффективных зарядов атомов в соединениях. Конкретная процедура оценки ионности (эффективных зарядов атомов) минералов производится в ряд этапов (Зуев, 1990):
- Находится общее число валентных электронов минерала, равное суммарному заряду остовов с обратным знаком. Проблема оценки числа участвующих в химической связи электронов у атомов в соединениях подробно рассмотрена в предыдущем разделе 1.2.2.
- Суммарное число валентных электронов минерала распределяется по соответствующим двухцентровым (межостовным) связям, т. е. оцениваются их электронные заряды.
- Электронные заряды связей делятся на доли электронного облака, локализованные у атомных остовов пропорционально их силовым характеристикам.
- Суммированием зарядов остовов и относящихся к ним долям электронных облаков вычисляются эффективные заряды атомов (ионов).
Как показано в монографии (Зуев, 1990), первый этап соответствует составлению остовно-электронной формулы (ОЭФ) соединения (минерала), второй — построению остовно-электронной модели (ОЭМ) соответствующей кристаллической структуры минерала, третий и четвертый этапы отвечают непосредственной оценке ионности связей и эффективных зарядов атомов с использованием кристаллохимических параметров соответствующей ОЭМ минерала. В качестве примеров приведем некоторые ОЭФ минералов и молекул, в которых по сравнению с монографиями (Зуев, 1990; Зуев, Денисов, Мочалов и др., 2000) внесены (в отдельных случаях) некоторые изменения (уточнения) в отношении фактической валентности неметаллов:
| железо (α-Fe) | — |
В этих формулах в квадратных скобках заключены атомные остовы, между которыми в круглых скобках находятся связывающие электроны (электриды). Неподеленные электроны показаны слева от катионного и справа от анионного остовов. Стрелки означают смещение связывающих электронов (электридов) к более электроотрицательному остову неметалла, указывая на полярный характер межатомных связей, а отсутствие стрелок под электридами указывает на ковалентный характер связей. Справа за прямой скобкой остовно-электронной формулы последовательно указаны координационные числа остовов и электридов, для последних имеет место линейное окружение остовами (КЧ = 2). Насколько правомерно или, другими словами, отвечает реальности представление кристаллов в виде ассоциации атомных остовов и связующих (а также неподеленных) электронов-электридов, что отражают предлагаемые остовно-электронные формулы? Подробное обоснование этого подхода имеется в уже достаточно обширной литературе (Bent, 1970; Гиллеспи, 1975; Cohen, 1984; Зуев, 1990; Гиллеспи, Харгиттаи, 1992; Семенов, 2001). Поэтому ограничимся лишь некоторыми дополнительными аргументами. Обычно ковалентную двухэлектронную связь трактуют в виде спаривания электронов у нейтральных атомов: например, Н-Н или Н ¯ Н в простейшем случае молекулы водорода Н2. Однако эти схемы явно упрощают реальную картину ковалентной связи, природу которой раскрывают квантово-химические методы (молекулярных орбит, валентных связей), в рамках которых необходимо учитывать обмен электронами у вступающих в связь атомов. Так, по Полингу (Полинг, 1974, с.140) молекулу водорода можно записать в виде резонанса двух структур: HA ↓ HB ↑ и HA ↑ HB ↓ Это значит, что электрон с положительным спином (↓) и электрон с отрицательным спином (↑) меняются местами, т. е. происходит обмен электронами у атомов водорода.Понятно, что обмен электронами у первоначально нейтральных атомов водорода НА и НВ предполагает отрыв у них электронов (с затратами энергий ионизации Ry = 13,6 эВ), образование остовов [HA + ] и [HB + ] и локализацию в межостовном пространстве ставшей общей (связующей) пары неразличимых электронов, которые попадают под действие силовых полей обоих остовов. Описанную ситуацию как раз и отражает остовно-электронная модель молекулы водорода — |[H + ](2e — )[H + ]|.[1] Аналогичным образом можно обосновать и другие более сложные остовно-электронные модели молекул и кристаллов. Имеются специальные формулы для оценки q в кристаллах (Зуев, 1990). Так, в случае простых (бинарного состава МхХу) минералов:
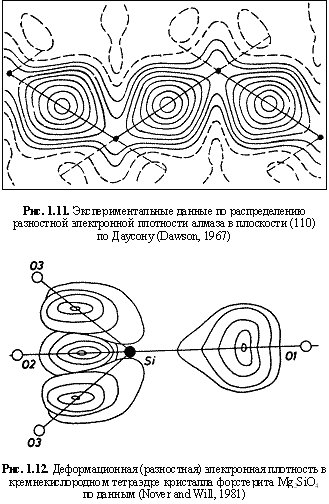
а в случае сложных минералов электронный заряд связи металл-неметалл находится по формуле:
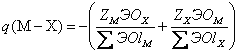
где ZM, ZX — числа валентных электронов атома, соответствующих зарядам остовов; ΣЭОlM, ΣЭОlX — суммы электроотрицательностей лигандов вокруг атомов М и Х в соответствующих атомных полиэдрах кристаллической структуры. Необходимые для таких расчетов координационные ЭО атомов имеются в (Зуев, 1990). Как показано ранее в разделе 1.2.1, исходя из сферической формы остовов и связывающих электронных облаков (электридов), обладающих соответствующими размерами и зарядами (рис. 1.3), можно строить остовно-электронные модели структур минералов. На рис. 1.4-1.8 даны примеры таких моделей для рутила, алмаза, кварца, сфалерита и периклаза. Важно подчеркнуть, что эти модели фактически демонстрируют новый остовно-электронный способ изображения кристаллических структур, в какой-то мере адекватный картам разностной электронной плотности (рис. 1.11-1.12), а также расчетам зарядовой электронной плотности в кристаллах по методу псевдопотенциала (Cohen, 1984). В последнем случае на соответствующих схемах, например, для кристалла Si, непосредственно фигурируют как связывающие электронные облака, так и остовы кремния. Остовно-электронные модели структур можно представлять в двух используемых в кристаллохимии аспектах (Зуев, 1990):
- как постройки из сферических остовов и электридов, обладающих соответствующими зарядами и радиусами (рис. 1.4-1.8);
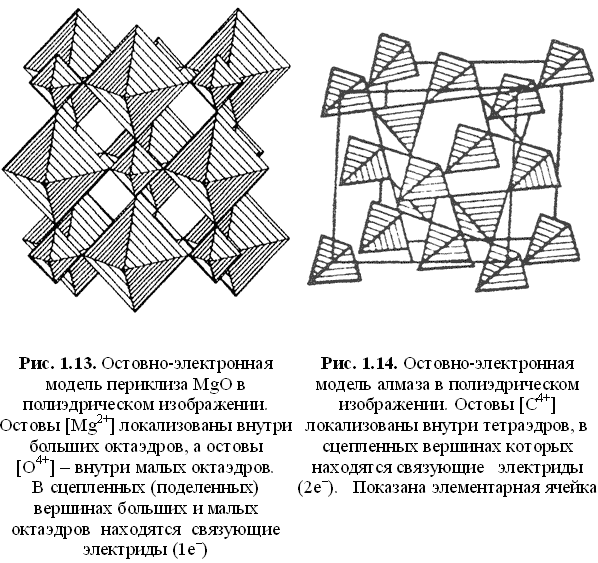
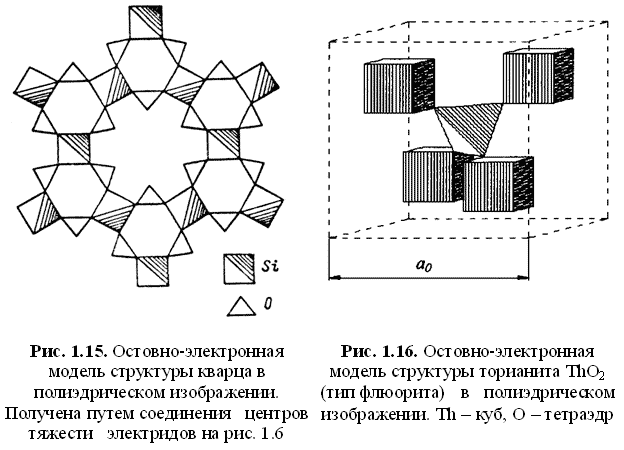
- как ассоциации остовных координационных полиэдров (рис. 1.13-1.16).
Во втором случае остовы катионных и анионных компонентов располагаются в центре соответствующих полиэдров, а связующие электроны локализованы в общих (поделенных) вершинах полиэдров. В свободных вершинах остовных полиэдров располагаются неподеленные электроны.
Полиэдрический способ изображения остовно-электронных моделей удобен и информативен: кристалл строится из сцепленных вершинами элементарных атомных (катионных и анионных) полиэдров-кирпичиков — октаэдров в структуре галита и периклаза, тетраэдров в структуре алмаза и сфалерита, кубов тория (церия) и тетраэдров кислорода в структуре торианита и церианита, октаэдров магния и тетраэдров кремния и кислорода в структуре форстерита и т. д. Согласно полиэдрическому способу изображения структуры, расстояние от центра полиэдра до общих (поделенных) вершин равно (по определению) ковалентному радиусу атома. Найденные по формулам (1.25) и (1.26) электронные заряды связей q(M-X) делятся между остовами пропорционально силовым параметрам FM и FX, в качестве которых можно использовать величины:
где L— общая лигандность остова, т. е. его координация с учетом неподеленных электронов. В монографии (Зуев, 1990) приведены многочисленные расчеты Q атомов в минералах с использованием параметров Z и соответственно F. Однако понятно, что одинаковые параметры Z слабо отражают индивидуальные химические особенности таких разных катионных остовов, как [Mg2+] и [Fe2+]. Поэтому более корректно, по-видимому, в формулах (1.27) вместо номинального заряда Z использовать суммарный эффективный заряд ядра, действующий на валентные (сверх остова) электроны атома — ΣZi*. Тогда эти формулы пре-образуются в:
где Zi* — действующий на валентный электрон эффективный заряд ядра, вычисляемый по правилам С. С. Бацанова (Бацанов и Звягина, 1966; Бацанов, 1986), либо рассчитываемый из потенциалов ионизации атома по формуле (1.12). Именно второй способ оценки эффективных зарядов ядер, как более простой, принят в данной работе.
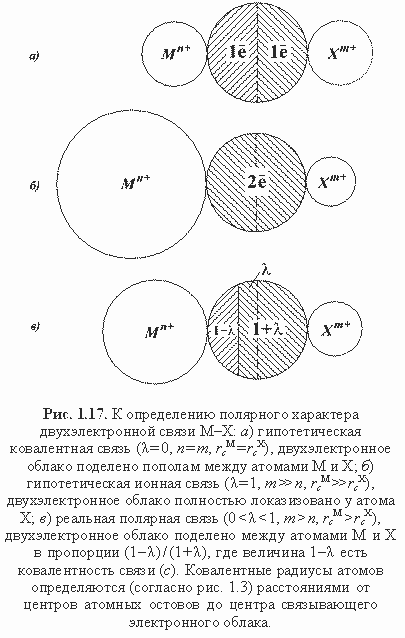
Использованием эффективных зарядов ядер в формулах (1.28) удается в явной форме, хотя и в суммарно усредненном виде, учесть силовые характеристики атома для всех его сверхостовных электронов. Так, в случае муассанита SiC, остовно-электронная формула которого |[Si 4+ ] (2e — )4 [C 4+ ]|, совершенно очевидна необходимость учета эффективных зарядов ядер для всех четырех валентных электронов атомов Si и C при оценке их силовых параметров. Вычисленные по формулам (1.27) или (1.28) силовые параметры используются для расчета ионного (полярного) характера связей М-Х кристалла:
Многочисленные расчеты показали близость оценок ионности связей в минералах по обеим формулам, хотя вторая из них предпочтительнее. Схема полярной связи М-Х приведена на рис. 1.17, где чисто ионная связь (λ = 1) является лишь условной абстракцией. На самом деле прообразом такой связи является, например, неподеленная пара электронов при остове кислорода в кварце (рис. 1.6). В этом случае ввиду отсутствия второго (катионного) остова можно принять FM = FM* = 0, тогда по формулам (1.29) и (1.30) λ = 1, т. е. неподеленную пару при остове можно отождествить с химической двухэлектронной связью 100%-полярности. Поскольку в реальных связях М-Х с двумя остовами всегда FM > 0 и FM* > 0, то чисто ионные связи в гетероатомных химических соединениях (минералах) невозможны, соответственно нереальны предельно-ионные структуры типа Na + Cl — , Mg 2+ O 2- , Al2 3+ O3 2- и др. Впрочем, это не означает, что по распределению зарядов реальные кристаллические соединения не могут быть весьма близки к предельно-ионным моделям типа указанных, о чем свидетельствуют современные данные расчетов электронной плотности. Заключительная процедура вычисления эффективных зарядов атомов в минералах производится по следующим формулам (Зуев, 1990):
где N — порядок связи М-Х, равный q/2. Возможен расчет Q атомов в минералах на основе величин параметров q, минуя параметры λ. Обозначим через с — электронную долю связи, локализованную на катионном компоненте, а через q—c соответственно — на анионном компоненте связи М-Х. Тогда из пропорции с/(q—c) = FM*/FX*имеем:
Зная КЧ атомов М и Х в структуре минерала, приходим к следующим формулам:
которые дают те же самые результаты, что и формулы (1.31). Для сопоставления вычисленных по разработанной методике Q атомов в кристаллических соединениях с соответствующими данными их диэлектрической ионности по Филлипсу-Ван Фехтену рекомендуется выражение:
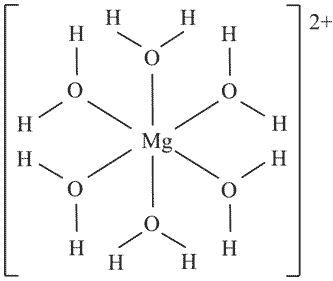
представляющее собой степень ионизации атомов, равную отношению эффективных зарядов к предельно-ионным зарядам атомов. В монографии (Зуев, 1990) даны примеры хорошего соответствия оценок эффективных зарядов атомов в кристаллах в рамках двух указанных подходов. Разработанная методика оценки ионности (эффективных зарядов атомов) универсальна в том смысле, что применима к соединениям различного типа, будь то молекулы, кристаллы, комплексы и т. д. Соответственно она была успешно апробирована на большом числе минералов и искусственных соединений. Для расчетов были использованы эффективные заряды ядер для валентных электронов атомов согласно (Zhang, 1982), электронные заряды связей в соединениях рассчитывались по приведенным формулам, либо непосредственно заимствовались из книги (Зуев, 1990). Ковалентные радиусы неметаллических компонентов rc(X) были приняты с учетом данных Слэтера, Урусова, Лебедева (Лебедев, 1969; Урусов, 1975; Зуев, 1990), а металлических — находились по разности rc(M) = d(M-X) — rc(X), где d(M-X) — среднее межатомное расстояние катион-анион в структуре. В качестве примеров рассчитаем эффективные заряды атомов в молекуле NaCl, галите NaCl, cфалерите ZnS, периклазе MgO, кварце SiO2, форстерите Mg2SiO4 и бишофите MgCl2(H2O)6. Остовно-электронная формула молекулы NaCl — |[Na + ]2e — [(Cl 7+ )6e — ]|, она обладает ординарной полярной связью Na-Cl. Размерные характеристики молекулы: d(Na-Cl) = 2,36 Å, rc(Cl) = 0,7 Å, rc(Na) = 1,66 Å. Эффективные заряды ядер для остовов ΣZi*(Na + ) = 1,78, ΣZi*(Cl + ) = 2,82, по формулам (1.28) F*(Na + ) = 1,78/1,662 = 0,646, F*(Cl+) = 2,82/0,72 = 5,755, по формуле (1.30) l(Na-Cl) = (5,755 — 0,646)/(5,755 + 0,646) = 0,8, т. е. получаем Na+0.8Cl-0.8, что соответствует ионности, вычисленной из дипольного момента молекулы NaCl (Бацанов, 1986). Остовно-электронная формула галита была приведена выше, q(Na-Cl) = 1e-, d(Na-Cl) = 2,82 Å, rc(Cl) = 1,0 Å, rc(Na) = 1,82 Å, в этом случае F*(Na + ) = 1,78/(6×1,822) = 0,09, F*(Cl 5+ ) = 23,76/(6×12) = 3,96. По формуле (1.30) λ(Na-Cl) = 0,96 и далее по формулам (1.31): Q(Na) = 1 — 6×0,5(1 — 0,96) = +0,88, Q(Cl) = 5 — 6×0,5(1 + 0,96) = -0,88, т. е. для галита имеем Na +0.88 Cl -0.88 , что соответствует диэлектрической ионности кристалла NaCl (Бацанов, 1982). Обратим внимание на заметный рост эффективных зарядов атомов при переходе от молекулы к кристаллу. В сфалерите ZnS КЧ атомов равны 4, q(Zn-S) = 2e — , d(Zn-S) = 2,35 Å, F*(Zn 2+ ) = 6,83/(4×1,35 2 ) = 0,94, F*(S 6+ ) = 30,35/(4×1 2 ) = 7,59, по формуле (1.30) λ(Zn-S) = 0,78 и далее по формулам (1.31), в которых N = 1: Q(Zn) = 2 — 4(1 — 0,78) = +1,12 и Q(S) = 6 — 4(1 + 0,78) = -1,12, т. е. для сфалерита получаем Zn +1.12 S -1.12 . В периклазе MgO (рис. 1.8) КЧ обоих атомов равны 6, q(Mg-O) = 1e — , d(Mg-O) = 2,10 Å, rc(O) = 0,55 Å, rc(Mg) = 1,55 Å, SZi*(Mg 2+ ) = = 5,21, SZi*(O 4+ ) = 13,94, F*(Mg 2+ ) = 5,21/(6×1,55 2 ) = 0,361, F*(O 4+ ) = 13,94/(6×0,55 2 ) = 7,68. По формуле (1.30) находим λ(Мg-O) = 0,91 и далее по формулам (1.31) Q(Mg) = 2 — 6×0,5(1 — 0,91) = +1,73, Q(O) = 4 — 6×0,5(1 + 0,91) = -1,73. В итоге получаем для периклаза Mg +1.73 O -1.73 . В случае кварца SiO2 (рис. 1.6) КЧ(Si) = 4(O), КЧ(О) = 2(Si), q(Si-O) = 3e-, d(Si-O) = 1,61 Å, rc(O) = 0,55 Å, rc(Si) = 1,06 Å, SZi*(Si 4+ ) = 15,205, SZi*(O 4+ ) = 13,94, F*(Si4+) = 15,205/(4×1,06 2 ) = 3,383, F*(O4+) = 13,94/(2×0,55 2 ) = 23,04. По формуле (1.30) λ(Si-O) = 0,744 и далее по формулам (1.31) находим: Q(Si) = 4 — 4×1,5(1 — — 0,744) = +2,46, Q(O) = 4 — 2×1,5(1 + 0,744) = -1,23. Таким образом, для кварца имеем Si +2.46 O2 -1.23 , что соответствует его диэлектрической ионности fi = 0,6 (Бацанов, 1982). В форстерите Mg2SiO4, структура которого характеризуется КЧ(Mg) = 6(O), КЧ(Si) = 4(O) и КЧ(О) = 3Mg+Si, усредненные электронные заряды связей, межатомные расстояния и ковалентные радиусы атомов: q(Mg-O) = 1,23e — , q(Si-O) = 2,31e — , d(Mg-O) = 2,12 Å, d(Si-O) = 1,63 Å, rc(Mg) = 1,57 Å, rc(Si) = 1,08 Å, rc(O) = 0,55 Å. Суммарные эффективные заряды ядер для валентных электронов атомов — ΣZi*(Mg 2+ ) = 5,21, ΣZi*(Si 4+ ) = 15,205, ΣZi*(O 4+ ) = 13,94, силовые параметры остовов — F*(Mg 2+ ) = 5,21/(6×1,57 2 ) = 0,352, F*(Si 4+ ) = 15,205/(4×1,08 2 ) = 3,259, F*(O 4+ ) = 13,94/(4×0,55 2 ) = 11,521. По формуле (1.30) λ(Mg-O) = 0,941, λ(Si-O) = 0,559 и далее по формулам (1.31): Q(Mg) = 2 — 6×0,615(1 — 0,941) = +1,782, Q(Si) = 4 — 4×1,155(1 — 0,559) = +1,963, Q(O) = 4 — 3×0,615(1 + 0,941)-1×1,155(1 + 0,559) = -1,382, т. е. приходим к Mg2 +1.78 Si +1.96 O4 -1.38 . Найденные в форстерите эффективные заряды оказались удивительно близкими к полученным японскими учеными из прецизионных расчетов электронной плотности — Mg2 +1.75 Si +2.1 O4 (Fujino, Sasaki, Takeuchi, Sadanada, 1981). В качестве заключительных примеров расчета Q атомов рассмотрим комплексные кристаллические соединения. Бишофит, как показали структурные исследования, имеет молекулярную структуру, состоящую из октаэдрических комплексов [Mg(H2O)6] 2+ , нейтрализованных двумя ионами Cl — . Соответственно формула минерала — [Mg(H2O)6] 2+ Cl2 — , а структурная формула отдельного иона [Mg(H2O)6] 2+ :
Здесь атом кислорода, имея плоско-треугольную координацию — КЧ(О) = Mg+2H, находится, по-видимому, в состоянии 3s2p 2 -гибридизации с неподеленной парой 2s 2 -электронов, и соответственно с остовом [O 4+ ]. Межатомные расстояния: d(Mg-O) = 2,08 Å, d(H-O) = 1,0 Å, ковалентные радиусы: rc(Mg) = 1,53 Å, rc(H) = 0,43 Å, rc(O) = 0,55 Å. Исходное распределение заряда в комплексе — [Mg2+(H2O)6], т. е. число валентных электронов у атома магния равно нулю. Тогда расчет по формуле (1.26) дает q(Mg-O) = -[(0x3,5)/(6×3,5) + (4×1,3)/(1,3 + 2×2,1)] = 0,945e — , q(H-O) = -[(1×3,5)/(1×3,5) + (4×2,1)/(1,3 + 2×2,1)] = 2,527e — . Силовые параметры остовов: F*(Mg 2+ ) = 5,21/(6×1,53 2 ) = 0,37, F*(H + ) = 0,85/(1×0,43 2 ) = 4,6, F*(O 4+ ) = 13,94/(3×0,55 2 ) = 15,36. Воспользовавшись в данном случае формулами (1.32), для связи Mg-O находим с = 0,0224e — , q—c = 0,9231e — , а для связи H-O c = 0,5824e — , q—c = 1,9446e — . Далее по формулам (1.33) находим Q(Mg) = 2 — 6×0,0224 = +1,866, Q(H) = 1 — 1×0,5824 = +0,417, Q(O) = 4 — 1×0,9231 — 2×1,9446 = -0,812. Результирующее распределение зарядов атомов в бишофите оказалось следующим — [Mg +1.866 x(H2 +0.417 O -0.812 )6] 2+ Cl2 — . Баланс зарядов в молекуле воды приводит к (H2O) +0.022 , что позволяет понять природу примеси ковалентной составляющей связи в данном и других аква-комплексах.[2] Как это очевидно, дело заключается в незначительной перекачке электронной плотности от молекул воды на свободные орбитали центрального катиона. Результатом этого является некоторое уменьшение формального заряда центрального катиона и соответственно — появление на молекулах воды указанного избыточного положительного заряда. Другими словами, от каждой из шести первоначально электронейтральных молекул воды на свободные орбитали центрального катиона (Mg 2+ ) переходит 0,022e-, и он приобретает эффективный заряд +2 — 0,022×6 = +1,868. В случае бианкита ZnSO4x6H2O конституцию этого минерала можно рассматривать как соединение из октаэдрических и тетраэдрических комплексных ионов — [Zn(H2O)6] 2+ и [SO4] 2- . Расчет приводит к следующим эффективным зарядам атомов в октаэдрическом комплексе [Zn +1.83 (H2 +0.418 O -0.807 )6] 2+ . Эффективные заряды атомов в комплексе [SO4] 2- вычислены для структуры с двойными связями и следующими параметрами: d(S-O) = 1,50 Å, rc(O) = 0,5 Å, rc(S) = 1,0 Å, q(S-O) = 4,0e — , F*(S 6+ ) = 30,35/(4×1 2 ) = 7,59, F*(O 2+ ) = 5,19/(1×0,52) = 20,76. Использование этих параметров приводит к следующим эффективным зарядам в сульфатном комплексе– [S +1.72 O4 -0.93 ] 2- , а общее распределение зарядов в бианките будет таковым: [Zn +1.83 (H2 +0.418 xO -0.807 )6] 2+ [S +1.72 O4 -0.93 ] 2- . Для водного сульфата FeSO4×6H2O аналогичные расчеты приводят к следующему распределению эффективных зарядов — [Fe +1.86 (H2 +0.411 O -0.80 )6] 2+ [S +1.72 O4 -0.93 ] 2- . Для октаэдрического аква-комплекса Fe(III) расчеты дали такие эффективные заряды атомов — [Fe +2.69 (H2 +0.424 O -0.796 )6] 3+ . Для безводных сульфатов M(II)SO4, структура которых характеризуется следующей взаимной координацией атомов: КЧ(М) = 2ОА + 4ОВ, КЧ(S) = 2OA + 2OB, КЧ(ОА) = M + S, КЧ(ОВ) = 2М + S, получились в порядке уменьшения Q(M) такие данные:
Mn +1.843 [S +1.418 O2(A) -0.662 O2(B) -1.969 ] Mg +1.837 [S +1.577 O2(A) -0.70 O2(B) -1.01 ] Fe +1.812 [ S +1.50 O2(A) -0.677 O2(B) -0.979 ] Cu +1.812 [S +1.577 O2(A) -0.696 O2(B) -0.998 ] Co +1.806 [ S +1.577 O2(A) -0.695 O2(B) -0.996 ] Zn +1.793 [S +1.577 O2(A) -0.693 O2(B) -0.991 ] Ni +1.788 [S +1.577 O2(A) -0.692 O2(B) -0.99 ]
Обратим внимание на антибатный ход изменения эффективных зарядов нерадикальных катионов M(II) и радикальных катионов S(VI) в рассмотренном ряду сульфатов и некоторое уменьшение Q(S) при переходе от свободного радикала [SO4] -2 к связанному в кристаллической решетке безводному сульфату. В таблице 1.32 приведены результаты оценок эффективных зарядов в ряде комплексов и молекул с плоско-треугольной и тетраэдрической координацией центрального атома кислородными лигандами. Таблица 1.32 Эффективные заряды атомов в некоторых комплексах и молекулах, рассчитанные в предположении двойных связей «катион-кислород»
| Комплекс (молекула) | d(M-On),Å | Эффективныезаряды атомов | Комплекс | d(M-O4),Å | Эффективные заряды атомов |
| [NO3] — | 1,24 | N +0,58 O3 — 0.527 | [ClO4] — | 1,51 | Cl +1.81 O4 — 0.703 |
| [CO3 ] 2 — | 1,28 | C +1 O3 — 1 | [MnO4] — | 1,59 | Mn +2.22 O4 — 0.805 |
| [SO4 ] 2 — | 1,50 | S +1.72 O4 — 0.93 | [CrO4 ] 2 — | 1,65 | Cr +2.53 O4 — 1.133 |
| ArO4 | 1,50 | Ar +1.94 O4 — 0.485 | [WO4 ] 2 — | 1,80 | W +2.8 O4 — 1.2 |
| FeO4 | 1,50 | Fe +2 O4 — 0.5 | [MoO4 ] 2 — | 1,83 | Mo +3.06 O4 — 1.26 |
В рамках продемонстрированного подхода были выполнены расчеты Qатомов в тех же минералах, что и в монографии (Зуев, 1990, стр. 55, таблица 3.9), в результате выяснилась близость расчетных эффективных зарядов атомов в обоих случаях и подтвердились три общих закономерности распределения этих зарядов в сложных минералах: 1) явление (или эффект) взаимного влияния катионов (ВВК); 2) различие в эффективных зарядах кристаллохимически нетождественных (по числу или сорту координирующих катионов) анионов, например, кислорода, обозначаемых ОА, ОВ, ОСи т. д.; 3) выполнения известного второго правила Л. Полинга о локальной компенсации ионных зарядов в структуре, если в качестве таковых использовать рассчитанные величины Q атомов. Эффект ВВК проиллюстрируем следующими уравнениями с указанием эффективных зарядов атомов:
Mg +1.73 O -1.73 +Si +2.46 O2 -1.23 = Mg +1.79 Si +2.20 O3 ;
2Mg +1.73 O -1.73 +Si+2.46O2 -1.23 = Mg2 +1.78 Si +1.96 O4 -1.38 ;
Zr +3.21 O2 +Si +2.46 O2 -1.23 = Zr +3.36 Si +2.14 O4 -1.375 ,
т. е. в сложном минерале (энстатите, форстерите, кианите, цирконе) по сравнению с простыми составляющими оксидами (периклазом, кварцем, корундом, бадделеитом,) происходит увеличение Q (уменьшение ковалентности связи) более слабого катиона (Mg, Al, Zr) за счет уменьшения Q (роста ковалентности связи) более сильного катиона (Si). Подробно эффекты ВВК в сложных минералах рассмотрены в монографии (Зуев, 1990), однако по поводу эффектов ВВК необходимо сделать весьма существенное дополнение, упущенное в указанной монографии. В самом деле, как меняется ионность (ковалентность) связей при переходе от исходных простых составляющих к сложному минералу? Для выяснения данного вопроса сравним средние параметры ионности fi и ковалентности (fc = 1-fi) для простых составляющих кристаллов, с одной стороны, и для соответствующего сложного соединения, с другой стороны. Такие сравнительные оценки удобно произвести по анионным компонентам соединений с использованием формулы 1.34, примеры соответствующих оценок приведены в таблице 1.33. По данным последнего (пятого) столбца таблицы 1.33 четко выявляется не имеющая исключений закономерность понижения ионности и роста ковалентности в сложном кристалле относительно этого параметра (естественно, среднего) в соответствующих простых составляющих кристаллах. Расчеты показали, что аналогичная картина имеет место и в случае содержащих более двух сортов катионов сложных кристаллических соединений, например: Ca3Al2Si3O12 (Δfi/Dfc = -0,07/+0,07), Mg3Al2Si3O12 (Δfi/Dfc = -0,04/+0,04), CaTiSiO5 (Δfi/Δfc = -0,05/+0,05), Be3Al2Si6O18 (Δfi/Δfc = -0,02/+0,02) и т. д. Таблица 1.33 Характер изменения параметров ионности и ковалентности в сложных кристаллических соединениях по сравнению с простыми составляющими кристаллами
| Q атомов в простых кристаллах | fi/fc | Q атомов в сложном кристалле | fi/fc | Dfi/Dfc |