- Эффект вентури при гкмп
- Гипертрофическая кирдиомиопатия
- Что такое Гипертрофическая кирдиомиопатия —
- Что провоцирует / Причины Гипертрофической кардиомиопатии:
- Патогенез (что происходит?) во время Гипертрофической кардиомиопатии:
- Симптомы Гипертрофической кардиомиопатии:
- КЛАССИФИКАЦИЯ
- ТЕЧЕНИЕ И ПРОГНОЗ
- Диагностика Гипертрофической кардиомиопатии:
- ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
- Лечение Гипертрофической кардиомиопатии:
- К каким докторам следует обращаться если у Вас Гипертрофическая кирдиомиопатия:
Эффект вентури при гкмп
Еще одним эхокардиографическим признаком ГКМП, имеющим диагностическое значение, является систолическое смещение передней створки митрального клапана кпереди (SAM — «systolic anterior motion»; далее для краткости — SAM-феномен). Этот феномен играет существенную роль в развитии обструкции выносящего тракта левого желудочка. Он состоит в том, что передняя створка митрального клапана, смещаясь во время систолы вперед в направлении межжелудочковой перегородки и иногда даже упираясь в нее, создает в выносящем тракте левого желудочка препятствие кровотоку.
При ЭхоКГ в М-режиме такое смещение наиболее отчетливо видно в том случае, когда ультразвуковой луч проходит через край передней створки митрального клапана. При отведении ультразвукового луча к базальным отделам в направлении аортального клапана путем наклона датчика увидеть систолическое смещение передней створки митрального клапана уже не удается. На эхокардиограмме, зарегистрированной в М-режиме, между двумя диастолическими «всплесками» створок митрального клапана с характерной конфигурацией его передней створки в виде буквы «м» и задней створки в виде буквы «w» находится систола желудочка с линией смыкания створок (линия CD), отклоняющейся к межжелудочковой перегородке.
Перед началом диастолического открытия створок митрального клапана происходит быстрое смещение его кзади. В типичных случаях SAM-феномен достигает максимума после двух третей систолы, когда еще контрактильность задней стенки не достигла максимума.
а) SAM-псевдофеномен. Следует помнить о возможности SAM-псевдофеномена. Он обычно наблюдается при заболеваниях, для которых характерна диффузная гипертрофия желудочков. В отличие от «настоящего» SAM-феномена, систолическое смещение митрального клапана по направлению к межжелудочковой перегородке происходит незначительно, а максимум смещения приходится на конец систолы, т.е. происходит синхронно с нарастанием контрактильности задней стенки левого желудочка.
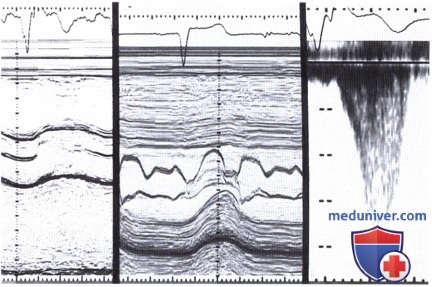
На среднем рисунке (М-режим) передняя створка митрального клапана касается межжелудочковой перегородки. Непрерывноволновая допплерография: вершина спектральной кривой (скорость кровотока 3,4 м/с) соответствует поздней фазе систолы; по форме кривая напоминает ножны и характерна для ГКМП (справа). 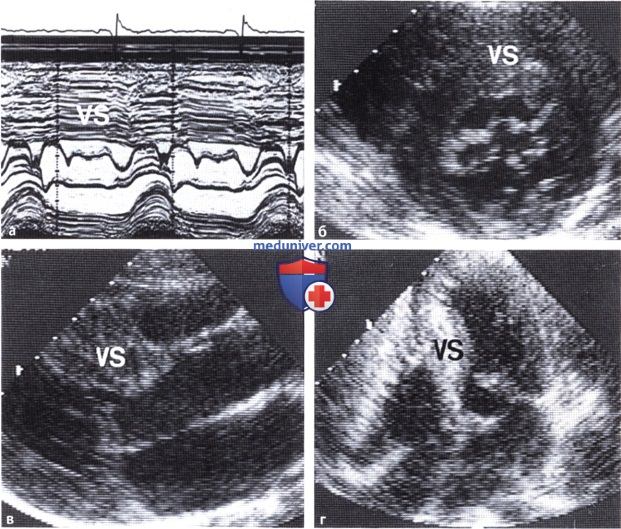
а — Передняя створка митрального клапана касается межжелудочковой перегородки (М-режим).
б — Смещение передней створки митрального клапана в направлении межжелудочковой перегородки (VS) на эхокардиограмме, полученной при сканировании сердца из парастернальной позиции по короткой оси.
в — Эхокардиограмма, полученная при сканировании из парастернальной позиции по длинной оси сердца.
г — Эхокардиограмма, зарегистрированная из апикальной четырехкамерной позиции.
б) Обструкция выносящего тракта левого желудочка. SAM-феномен тесно связан с динамической обструкцией выносящего тракта левого желудочка. Степень смещения передней створки митрального клапана и соприкосновения ее с межжелудочковой перегородкой тесно коррелирует с величиной градиента в выносящем тракте левого желудочка.
в) Эффект Вентури. Долгое время SAM-феномен приписывался эффекту Вентури. Лишь в последние годы правильность такого объяснения феномена ставится под сомнение. В основе эффекта Вентури лежит ускорение кровотока в выносящем тракте левого желудочка, связанное с его обструкцией и создающее в соответствии с уравнением Бернулли зону пониженного давления. В результате возникающего присасывающего эффекта митральный клапан смещается по направлению к межжелудочковой перегородке, выносящий тракт сужается еще больше и градиент давления возрастает.
г) Морфологические изменения. В специально проведенных исследованиях удалось выяснить, каким образом морфологические изменения в митральном клапанном аппарате, включая подклапанные структуры и сосочковые мышцы, влияют на систолическое смещение передней створки митрального клапана, и в то же время опровергнуть роль эффекта Вентури в механизме такого смещения. Если бы SAM-феномен был обусловлен присасывающим эффектом Вентури, то основная предпосылка этого эффекта — высокая скорость кровотока в выносящем тракте левого желудочка — должна была бы возникнуть уже к началу SAM-феномена. Однако скорости кровотока в выносящем тракте в начале систолы длительное время не уделяли должного внимания, и лишь в последнее время удалось показать, что к началу систолического смещения створки скорость кровотока в выносящем тракте левого желудочка нормальная и, как правило, не превышает 1 м/с.
д) Тяговое усилие. По мнению исследователей, в патогенезе SAM-феномена доминирующую роль играет тяговое усилие (в англоязычной литературе «drag forces»). Постулируется, что такое смещение вызвано тягой, создаваемой кровотоком («drag») в выносящем тракте левого желудочка, скорость которого в начале систолы вплоть до начала смещения передней створки митрального клапана остается почти нормальной. Причиной такой тяги являются морфологические изменения при ГКМП, которые затрагивают и митральный клапан с его подклапанными структурами. Эти изменения включают, помимо гипертрофии сосочковых мышц, также их смещение и изменение взаимной ориентации. Эти морфологические изменения сосочковых мышц вызывают нарушение нормальной геометрии клапанного аппарата и его подклапанных структур и смещение их кпереди.
Кроме того, у больных ГКМП по сравнению со здоровыми лицами чаще отмечается непосредственное вплетение волокон сосочковых мышц в свободный край передней створки митрального клапана. У больных ГКМП створки митрального клапана часто бывают более широкими и длинными. В совокупности все перечисленные факторы обусловливают выявляемое при ЭхоКГ смещение митрального клапанного аппарата в выносящий тракт левого желудочка и уменьшение расстояния между передней створкой митрального клапана и межжелудочковой перегородкой (митрально-септального интервала). Таким образом, митральный клапанный аппарат оказывается в потоке крови, выбрасываемой через выносящий тракт левого желудочка, и создает тяговое усилие. В результате передняя створка митрального клапана оказывается «втянутой» в поток крови и по мере выбрасывания крови все более смещается в направлении межжелудочковой перегородки.
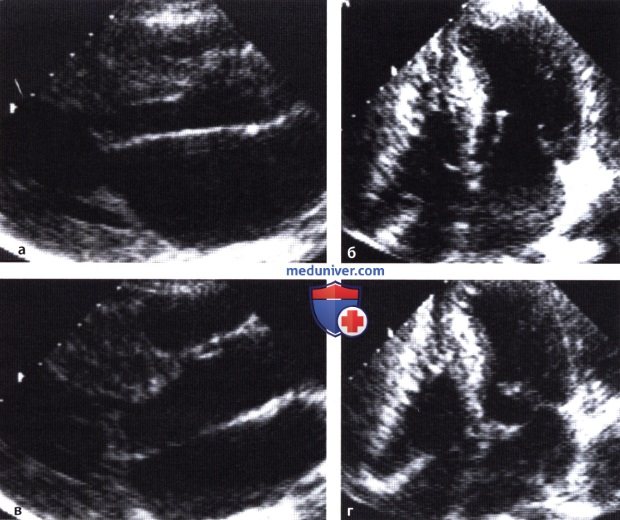
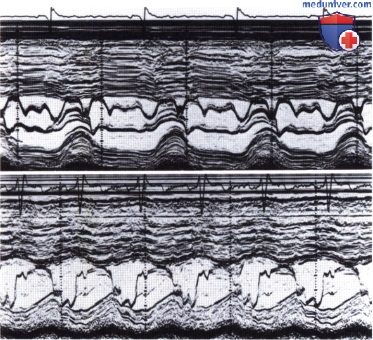
а — Эхокардиограмма, полученная при сканировании сердца из парастернальной позиции по длинной оси. Стоп-кадр сделан в момент диастолы.
б — Эхокардиограмма, полученная при сканировании сердца из апикальной четырехкамерной позиции.
в — SAM-феномен. Эхокардиограмма получена при сканировании сердца из парастернальной позиции по длинной оси.
г — Эхокардиограмма, полученная при сканировании сердца из апикальной четырехкамерной позиции. 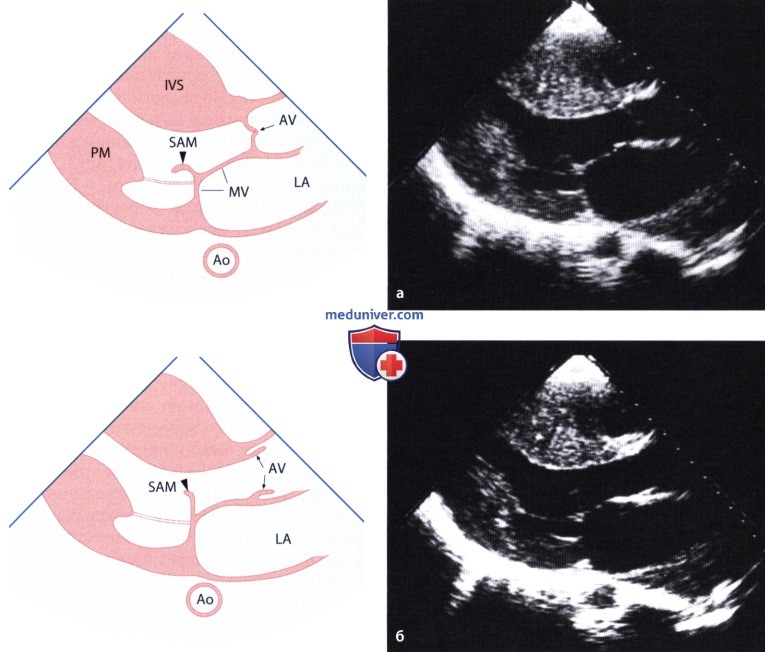
а — Начало систолического смещения передней створки митрального клапана кпереди в ранней фазе систолы перед открытием аортального клапана.
б — Дальнейшее смещение передней створки вперед по мере открытия аортального клапана. 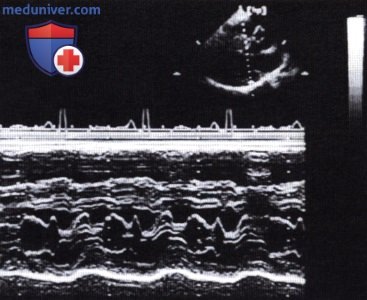
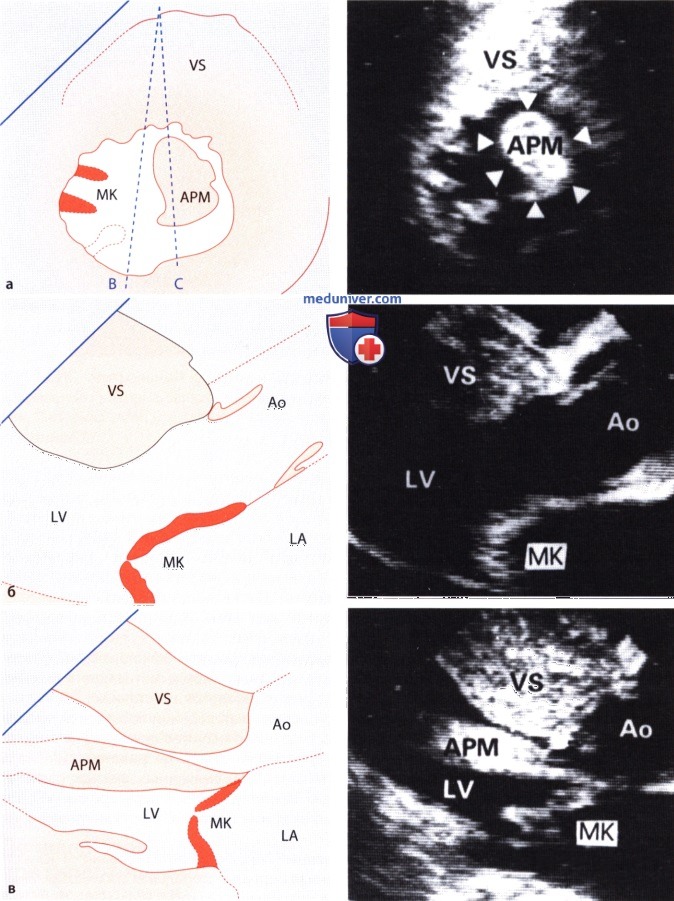
а — Эхокардиограмма, зарегистрированная из парастернальной позиции по короткой оси в диастолу. Сосочковая мышца (АРМ) отчетливо смещена кпереди.
б и в — Эхокардиограмма, полученная у того же больного: б — сосочковая мышца не попала в плоскость сканирования, в — сосочковая мышца расположена в плоскости сканирования.
На рисунке б, на котором сосочковая мышца не попала в плоскость сканирования, обструкции нет. При незначительном латеральном смещении датчика, когда переднелатеральная сосочковая мышца попадает в плоскость сканирования, видно сужение выносящего тракта гипертрофированной сосочковой мышцей, которая непосредственно соединена с передней створкой митрального клапана. 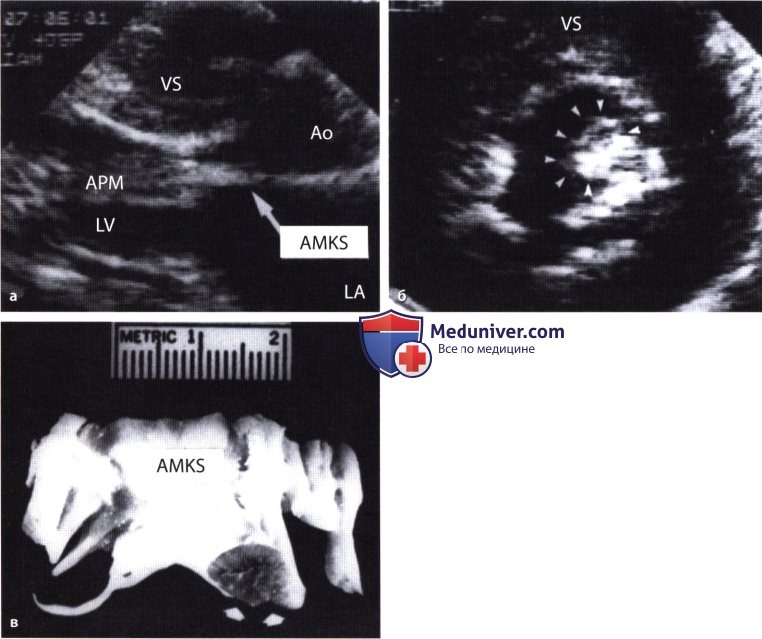
а — Непосредственное прикрепление гипертрофированной переднелатеральной сосочковой мышцы (АРМ) к передней створке митрального клапана (AMKS), вызвавшее значительное сужение выносящего тракта левого желудочка (сканирование из парастернальной позиции по длинной оси).
б — Гипертрофированная переднелатеральная сосочковая мышца (АРМ), смещенная кпереди, располагается в непосредственной близости от переднего отдела межжелудочковой перегородки (VS), что отчетливо видно на операционном препарате. Эхокардиограмма получена при сканировании из парастернальной позиции по короткой оси.
в — Митральный клапанный аппарат больного ГКМП, иссеченный перед его протезированием искусственным клапаном. Можно видеть, как гипертрофированная переднелатеральная сосочковая мышца прикрепляется непосредственно к передней створке митрального клапана. 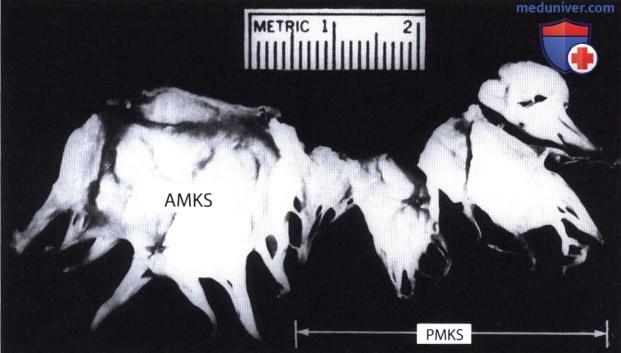
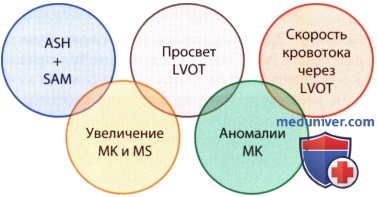
е) Заключение. Отправной точкой SAM-феномена при ГКМП, который вначале появляется при умеренных скоростях кровотока в выносящем тракте левого желудочка, являются морфологические изменения в митральном клапанном аппарате. Смещение передней створки митрального клапана появляется в результате действия упомянутого выше тягового усилия («drag forces»), создаваемого кровотоком. Механизм Вентури, который, как было сказано, мог бы участвовать в патогенезе SAM-феномена лишь при довольно высокой скорости кровотока к началу смещения, существенной роли не играет.
В заключение следует сказать, что патофизиологические механизмы обструкции выносящего тракта левого желудочка и связанного с ней SAM-феномена многогранны и зависят от ряда гемодинамических и морфологических параметров, которые перечислены ниже:
— тяговое усилие, создаваемое кровотоком («drag forces»),
— гипертрофия передней части базальных отделов межжелудочковой перегородки,
— сужение выносящего тракта левого желудочка,
— изменение геометрии левого желудочка,
— смещение сосочковых мышц и изменение их взаимной ориентации,
— изменение нормального положения митрального клапана вместе с подклапанными структурами,
— увеличение ширины и длины створок митрального клапана.
Источник
Гипертрофическая кирдиомиопатия
Что такое Гипертрофическая кирдиомиопатия —
Гипертрофическая кардиомиопатия (ГКМП) — это первичное поражение миокарда, характеризующееся выраженной гипертрофией миокарда ЛЖ (реже ПЖ), нормальными или уменьшенными размерами полости ЛЖ, значительным нарушением диастолической функции желудочка и частым возникновением нарушений сердечного ритма. Различают асимметричную и симметричную формы ГКМП. Чаще встречается асимметричная форма с преимущественной гипертрофией верхней, средней или нижней трети МЖП, толщина которой может быть в 1,5-3 раза больше толщины задней стенки ЛЖ и превышает 15 мм).
Иногда толщина МЖП достигает 50-60 мм. В части случаев гипертрофия МЖП сочетается с увеличением мышечной массы передней или переднебоковой стенки ЛЖ, тогда как толщина задней стенки остается почти нормальной). В некоторых случаях преобладает гипертрофия верхушки (апикальная форма ГКМП) с возможным переходом на нижнюю часть МЖП или переднюю стенку ЛЖ.
Для симметричной формы ГКМП типично одинаковое утолщение передней, задней стенки ЛЖ и МЖП (концентрическая гипертрофия ЛЖ). В некоторых случаях, наряду с описанными изменениями ЛЖ, может гипертрофироваться миокард ПЖ. Масса сердца резко увеличивается, достигая в отдельных случаях 800-1000 г. Полость ЛЖ обычно сужена. Особый интерес представляют случаи так называемой обструктивной формы ГКМП с асимметричным (или тотальным) поражением МЖП и обструкцией выходного тракта ЛЖ. В этих случаях говорят о наличии у больного идиопатического субаортального подклапанного (мышечного) стеноза, который приводит к наиболее выраженным изменениям внутрисердечной гемодинамики.
При гистологическом исследовании миокарда обнаруживают несколько специфичных для этого заболевания признаков: дезориентированное хаотичное расположение кардиомиоцитов; фиброз миокарда в виде диффузного или очагового развития соединительной ткани в сердечной мышце, причем во многих случаях с образованием обширных и даже трансмуральных рубцовых полей; утолщение стенок мелких коронарных артерий за счет гипертрофии гладкомышечных клеток и увеличения содержания фиброзной ткани в сосудистой стенке.
Заболеваемость ГКМП составляет 2-5 человек на 100 тысяч населения или 2-3 случая на 1000 человек молодого возраста (20-35 лет). Преобладают необструктивные формы ГКМП, частота обнаружения которых примерно в 2-3 раза больше чем обструктивных. Мужчины заболевают чаще женщин. Первые клинические проявления болезни возникают в молодом возрасте (20-35 лет).
Что провоцирует / Причины Гипертрофической кардиомиопатии:
В настоящее время можно условно говорить о ГКМП как о заболевании неизвестной этиологии. Благодаря достижениям современной генетики установлено, что в основе возникновения ГКМП лежат генетические факторы, а именно: передающиеся по наследству аномалии или спонтанные мутации в локусах нескольких генов, контролирующих структуру и функцию сократительных белков миокарда (b-миозина тяжелых цепей, тропонина Т, тропонина I, a-тропомиозина и миозинсвязывающего белка С). Гены располагаются в хромосомах 1, 2, 7, 11, 14, 15. Генный дефект заключается в изменении последовательности аминокислот. В большинстве случаев известные мутации генов приводят к синтезу аномальной тяжелой цепи b-миозина, реже — тропонина Т и a-тропомиозина. Аномальные белки как бы запускают процесс дезорганизации саркомера и приводят к нарушению его структуры и функции.
В 50% случаев ГКМП носит семейный характер, и наследование аномалий генов происходит по аутосомно-доминантному типу. Примерно у половины близких родственников больных семейной ГКМП выявляются эхокардиографические признаки гипертрофии МЖП. В других случаях не удается доказать семейный характер ГКМП и заболевание связывают со спонтанными мутациями названных генов, возможно, происходящими под действием неблагоприятных факторов среды (спорадические формы ГКМП). Дифференциация семейных и спорадических форм ГКМП затруднена. Определенное значение в формировании заболевания придается действию нейрогормональных факторов: катехоламинов, инсулина, соматотропного гормона, нарушениям функции щитовидной и паращитовидной желез.
Патогенез (что происходит?) во время Гипертрофической кардиомиопатии:
Формирование выраженной асимметричной или симметричной гипертрофии ЛЖ, наряду с фиброзом миокарда и аномальным утолщением стенки мелких КА, приводит к выраженным изменениям внутрисердечной гемодинамики и коронарного кровообращения, которые объясняют практически все клинические проявления ГКМП.
Диастолическая дисфункция ЛЖ составляет основу гемодинамических нарушений при любых формах ГКМП (обструктивных и необструктивных). Диастолическая дисфункция вызвана увеличением ригидности гипертрофированной и склерозированной сердечной мышцы и нарушением процесса активного диастолического расслабления желудочков. Закономерными следствиями нарушения диастолического наполнения ЛЖ являются: возрастание конечно-диастолического давления в ЛЖ; повышение давления в ЛП и в венах малого круга кровообращения; расширение ЛП (при отсутствии дилатации ЛЖ); застой крови в малом круге кровообращения (диастолическая форма ХСН); уменьшение сердечного выброса (на более поздних стадиях развития заболевания) в результате затруднения диастолического наполнения желудочка и снижения КДО (уменьшения полости ЛЖ).
Систолическая функция желудочка у больных ГКМП не нарушена или даже повышена: сила сокращения гипертрофированного ЛЖ и скорость изгнания крови в аорту обычно резко возрастают. Увеличивается и ФВ. Однако это вовсе не противоречит отмеченному выше снижению ударного объема и сердечного выброса, поскольку и высокие значения ФВ, и низкие значения УО объясняются резким уменьшением КДО и КСО. Поэтому при снижении КДО увеличивается ФВ и уменьшается УО.
Относительная коронарная недостаточность — один из характерных признаков ГКМП. Нарушения коронарного кровотока обусловлены: сужением мелких коронарных артерий за счет гипертрофии гладкомышечных клеток и развития соединительной ткани в стенке артерий; повышением КДД в ЛЖ, что приводит к снижению градиента давления между аортой и полостью ЛЖ, уменьшению коронарного кровотока; высоким внутримиокардиальным напряжением стенки сердца, что способствует сдавлению мелких субэндокардиальных коронарных сосудов; несоответствием значительно увеличенной мышечной массы ЛЖ и капиллярного русла сердца; повышением потребности миокарда в кислороде на фоне гиперконтрактильности сердечной мышцы.
Высокий риск желудочковых и наджелудочковых аритмий, а также риск внезапной смерти, обусловлен преимущественно выраженной электрической негомогенностью и нестабильностью миокарда желудочков и предсердий, которые у больных ГКМП возникают в результате очагового мозаичного расположения участков миокарда, обладающих различными электрофизиологическими свойствами (гипертрофия, очаговый фиброз, локальная ишемия). Определенное значение в возникновении аритмий имеет растяжение стенки дилатированного ЛП, а также токсическое воздействие катехоламинов на миокард желудочков.
Динамическая обструкция выносящего тракта ЛЖ при идиопатическом субаортальном мышечном стенозе развивается у больных с обструктивной формой ГКМП преимущественно при асимметричной гипертрофии МЖП. Выносящий тракт ЛЖ образован проксимальным отделом МЖП и передней створкой митрального клапана. При выраженной гипертрофии проксимальной части МЖП происходит сужение выносящего тракта. В результате во время изгнания крови в этом отделе резко возрастает линейная скорость кровотока и, согласно феномену Бернулли, значительно уменьшается боковое давление, которое оказывает поток крови на структуры, образующие выносящий тракт.
В месте сужения выносящего тракта образуется зона низкого давления, которая оказывает присасывающее действие на переднюю створку митрального клапана (эффект насоса Вентури). Эта створка сближается с МЖП и в течение некоторого времени даже полностью смыкается с ней, создавая препятствие на пути изгнания крови в аорту. Такое препятствие может сохраняться В течение 60-80 мс, на протяжении продолжительности всего периода изгнания.
Патологическое движение передней створки митрального клапана навстречу МЖП усугубляется при аномальном расположении папиллярных мышц, неспособных удерживать створки митрального клапана в сомкнутом состоянии. В результате относительно продолжительного смыкания передней створки МЖП создается внутрижелудочковый градиент давления, величина которого характеризует степень обструкции выносящего тракта ЛЖ. В тяжелых случаях внутрижелудочковый градиент давления может достигать 80-100 мм рт. ст.
На величину градиента давления и степень обструкции выносящего тракта оказывают существенное влияние 3 основных фактора: сократимость миокарда ЛЖ, величина преднагрузки, величина постнагрузки. Чем выше сократимость ЛЖ, тем больше линейная скорость кровотока в суженном участке выносящего тракта и выше присасывающий эффект Вентури. Поэтому все факторы, увеличивающие сократимость желудочка, усиливают обструкцию выносящего тракта (физическая нагрузка, тахикардия, психоэмоциональное напряжение, введение сердечных гликозидов и других инотропных средств, любая активация САС, гиперкатехоламинемия). Брадикардия, введение b-адреноблокаторо, блокаторов медленных кальциевых каналов, дизопирамида способствуют уменьшению обструкции.
Снижение преднагрузки приводит к дальнейшему уменьшению объема желудочка и размеров выносящего тракта, сопровождается усугублением его обструкции. Поэтому степень обструкции возрастает при внезапном переходе больного из горизонтального в вертикальное положение, при пробе Вальсальвы, приеме нитратов, при тахикардии. Горизонтальное положение больного, увеличение ОЦК уменьшают степень обструкции.
Уменьшение постнагрузки (снижение уровня АД при приеме артериальных вазодилататоров) приводит к увеличению обструкции выносящего тракта ЛЖ, тогда как ее увеличение (подъем уровня АД, длительная статическая нагрузка, воздействие холода, введение мезатона, норадреналина) способствует уменьшению внутрижелудочкового градиента давления и степени обструкции. В таблице 39 суммированы сведения о факторах, влияющих на степень обструкции выносящего тракта ЛЖ у больных с обструктивной ГКМП.
Таблица 39. Факторы, влияющие на обструкцию при ГКМП
Динамический характер обструкции выносящего тракта у больных ГКМП объясняет тот факт, что величина внутрижелудочкового градиента давления постоянно меняется, в том числе под действием перечисленных выше факторов. Внутрижелудочковая обструкция может развиваться не только при гипертрофии МЖП, но и при поражении других отделов ЛЖ. В редких случаях возможна также обструкция выносящего тракта ПЖ.
Симптомы Гипертрофической кардиомиопатии:
КЛАССИФИКАЦИЯ
Различают три гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (с базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (при приеме нитратов или внутривенным введении изопротеренола). Диапазон клинических вариантов течения варьирует от бессимптомных до неуклонно прогрессирующих, трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Жалобы
Клинические проявления ГКМП определяются нарушениями внутрисердечной гемодинамики. Длительное время заболевание может протекать бессимптомно, объективные признаки ГКМП выявляются случайно. Первые клинические проявления чаще возникают в возрасте 25-40 лет. Одышка вначале появляется при физической нагрузке, а затем и в покое. Она обусловлена повышением КДД ЛЖ, давления в ЛП и легочных венах и является следствием диастолической дисфункции ЛЖ. В некоторых случаях одышка может усиливаться при переходе больного в вертикальное положение, особенно у пациентов с обструктивной формой ГКМП, что связано с уменьшением венозного притока крови к сердцу и еще бульшим снижением наполнения ЛЖ.
Головокружения и обмороки объясняются преходящим нарушением перфузии головного мозга и обусловлены снижением сердечного выброса и наличием обструкции выносящего тракта ЛЖ. Головокружения и обмороки возможны при быстром переходе больного из горизонтального в вертикальное положение, что снижает величину преднагрузки и также увеличивает обструкцию выносящего тракта. Обмороки провоцируются также физической нагрузкой, натуживанием и даже приемом пищи.
В последнем случае нередко возникает вазодилатация, снижение постнагрузки и увеличение обструкции выносящего тракта. Приступы стенокардии у больных ГКМП возникают в результате сужения мелких коронарных артерий и изменений внутрисердечной гемодинамики, описанных выше. Чаще стенокардия появляется у больных во время выполнения физической нагрузки или психоэмоционального напряжения. Интересно, что прием нитратов не купирует стенокардию, а, наоборот, может ухудшить состояние больного, поскольку усиливает степень обструкции и способствует усугублению диастолической дисфункции ЛЖ. Сердцебиения и перебои в работе сердца могут быть связаны с возникновением фибрилляции предсердий, наджелудочковой и желудочковой экстрасистолии и пароксизмальной тахикардии. Иногда первым проявлением ГКМП может быть внезапная сердечная смерть.
Физикальное исследование
У больных с необструктивной формой ГКМП объективные признаки заболевания могут отсутствовать в течение длительного времени, пока не разовьется выраженный застой крови в малом круге кровообращения. У больных с обструктивной ГКМП объективные признаки заболевания выявляются достаточно рано при обследовании сердечно-сосудистой системы.
Пальпация, перкуссия сердца
Верхушечный толчок в большинстве случаев усилен за счет гипертрофии ЛЖ. Нередко пальпируется так называемый двойной верхушечный толчок, что связано с усиленным сокращением ЛП, а затем ЛЖ. В более редких случаях можно пропальпировать тройной верхушечный толчок, обусловленный наличием усиленного сокращения ЛП (“волна a”), а затем — временным прекращением изгнания крови в аорту вследствие полного смыкания передней створки митрального клапана и МЖП, что создает своеобразный “провал” на основной систолической волне верхушечной кардиограммы. Иногда вдоль левого края грудины определяется систолическое дрожание. Границы сердца могут быть несколько смещены влево, “талия” сердца сглажена за счет дилатированного ЛП.
Аускультация сердца
Аускультация сердца позволяет выявить наиболее специфичные признаки обструктивной формы ГКМП. Основные тоны сердца часто не изменены, возможно расщепление I тона в связи с несинхронным сокращением левого и правого желудочков. Акцент II тона на легочной артерии появляется при значительном повышении давления в легочной артерии. Часто на верхушке выслушивается пресистолический ритм галопа за счет появления патологического IV тона сердца (усиление сокращения ЛП и высокое КДД в ЛЖ).
У части больных отмечается парадоксальное расщепление II тона на аорте. Систолический шум является основным аускультативным признаком обструктивной ГКМП. Он отражает возникновение динамического градиента давления между ЛЖ и аортой. Шум громкий, грубый, выслушивается обычно вдоль левого края грудины и не проводится на сосуды шеи. Характер шума — нарастающе-убывающий (ромбовидной формы), причем шум обычно отстоит от I тона на значительном расстоянии. Это обусловлено тем, что в начале фазы изгнания ток крови в аорту беспрепятственный, и только в середине систолы возникает динамическая обструкция выносящего тракта ЛЖ и турбулентный ток крови.
Систолический шум, так же как и сама обструкция выносящего тракта, усиливается при физической нагрузке, снижении АД, уменьшении венозного притока крови к сердцу (под действием нитратов). Ослабление систолического шума наблюдается при уменьшении сократимости миокарда (прием b-адреноблокаторов), повышении АД, а также в горизонтальном положении больного. Следует иметь в виду, что у некоторых больных систолический шум определяется только после физической нагрузки. На верхушке часто выслушивается систолический шум митральной регургитации. Он более мягкий, нежный, начинается сразу после I тона, носит диастолосистолический характер и проводится в подмышечную область.
Артериальный пульс, АД
В тяжелых случаях обструктивной ГКМП определяется дикротический пульс. АД не имеет специфических особенностей. Нередко у больных ГКМП имеется сопутствующая АГ и АД у них повышено.
ТЕЧЕНИЕ И ПРОГНОЗ
Прогноз больных ГКМП достаточно серьезен. Внезапная сердечная смерть наступает у 1-4% больных в год, еще выше частота внезапной смерти у детей (до 6% в год). У небольшой части больных ГКМП (около 10%) возможна трансформация болезни в дилатационную КМП. В 10% случаев у больных ГКМП развивается картина инфекционного эндокардита.
Диагностика Гипертрофической кардиомиопатии:
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Электрокардиография
Наибольшее диагностическое значение имеют: признаки гипертрофии ЛЖ; неспецифические изменения конечной части желудочкового комплекса (депрессия сегмента RS-Т и инверсия зубца Т); признаки электрической перегрузки, гипертрофии предсердия (Р-mitrale); патологический зубец Q и комплекс QS регистрируются у больных ГКМП.
Они отражают аномальное распространение возбуждения по МЖП или другим гипертрофированным отделам ЛЖ. Эти моментные векторы проецируются на отрицательные части осей отведений II, III, аVF, в которых и регистрируется патологический зубец Q. Если преобладает гипертрофия нижней части МЖП и верхушки, начальный и средний моментные векторы отклоняются вниз, проецируясь на отрицательные части осей I, аVL и патологический Q выявляется в этих отведениях. Причиной появления патологических зубцов Q или комплекса QS служат обширные участки фиброзной ткани в МЖП, передней или задней стенках ЛЖ.
Наджелудочковые и желудочковые аритмии при суточном мониторировании ЭКГ по Холтеру изменения выявляются в 80% случаев. Часто регистрируются желудочковые аритмии высоких градаций, которые являются предвестником фибрилляции желудочков и внезапной сердечной смертности. При верхушечной локализации гипертрофии в левых грудных отведениях могут регистрироваться гигантские отрицательные зубцы Т и выраженная депрессия сегмента RS-Т. Иногда наблюдается несоответствие изменений ЭКГ и данных ЭхоКГ. Oписаны случаи ГКМП, длительное время протекавшие бессимптомно, единственным проявлением которой были гигантские зубцы R и глубокие S в одном или нескольких грудных отведениях. В других случаях при наличии выраженной гипертрофии (по данным ЭхоКГ) ЭКГ была практически нормальной.
Эхокардиография
Эхокардиографическое исследование является основным методом верификации диагноза. Наибольший интерес представляет ультразвуковая диагностика обструктивной формы ГКМП с асимметричной гипертрофией МЖП и обструкцией выносящего тракта ЛЖ.
Эхокардиографическими признаками являются: утолщение МЖП и ограничение ее подвижности (для асимметричной ГКМП характерно соотношение толщины МЖП к толщине свободной стенки ЛЖ 1,3 и больше); уменьшение полости ЛЖ и расширение ЛП; систолическое движение передней створки митрального клапана в результате значительного ускорения кровотока в суженной части выносящего тракта ЛЖ; систолическое прикрытие аортального клапана в середине систолы и появление динамического градиента давления в выносящем тракте ЛЖ в результате уменьшения изгнания крови в аорту и смыкания передней створки митрального клапана с МЖП; при допплер-эхокардиографическом исследовании выявляется высокая линейная скорость кровотока в выносящем тракте ЛЖ и двугорбая форма спектрограммы скорости трансаортального потока крови; выраженная диастолическая дисфункция ЛЖ; гиперкинезия задней стенки ЛЖ; при двухмерной ЭхоКГ из верхушечного или субкостального доступа, при исследовании кровотока в выносящем тракте ЛЖ в допплеровском режиме выявляется митральная регургитация.
Рентгенография
Рентгенологическое исследование не имеет решающего значения в диагностике ГКМП. Часто контуры сердца оказываются нормальными. При выраженной митральной регургитации определяется расширение тени ЛП. При выраженной легочной гипертензии выявляется выбухание второй дуги левого контура сердца (Conus pulmonalis), расширение корней легких и рентгенологические признаки венозной (реже артериальной) легочной гипертензии.
Лечение Гипертрофической кардиомиопатии:
Лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, является в большей степени симптоматическим и паллиативным. Основными задачами лечебных мероприятий являются не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания. Больным ГКМП рекомендуют избегать значительных физических нагрузок, которые сопровождаются тахикардией, еще большим ухудшением диастолического наполнения ЛЖ и возрастанием внутрижелудочкового градиента давления в выносящем тракте ЛЖ.
При выборе лечебной программы оценивают риск внезапной смерти этих больных. Факторами высокого риска внезапной смерти при ГКМП являются молодой возраст (менее 14 лет); наличие у больных обмороков и тяжелых желудочковых нарушений ритма (спонтанная устойчивая желудочковая тахикардия, фибрилляция желудочков), эпизодов неустойчивой желудочковой тахикардии по результатам суточного ЭКГ мониторирования; неадекватность прироста АД в ходе нагрузочного теста; выраженная (более 3 см) гипертрофия миокарда ЛЖ; указание на ГКМП и/или внезапную смерть в семейном анамнезе. Вероятность внезапной смерти повышается при наличии у больного фибрилляции предсердий (пароксизмальной, постоянной тахиформы мерцательной аритмии), выраженной ишемии миокарда, обструкции выходного тракта ЛЖ.
Большое значение отводится обнаружению у больных с семейным характером ГКМП мутаций, ассоциированных с тяжелым прогнозом. Установление высокого риска внезпной смерти определяет необходимость более активной лечебной тактики (уточнение лекарственной терапии, использование пейсмейкеров, дефибрилляторов-кардиовертеров, проведение кархирургических операций). Наиболее адекватным лечебным мероприятием является имплантация дефибриллятора-кардиовертера с целью первичной или вторичной профилактики жизнеугрожающих аритмий и улучшения прогноза.
Консервативное лечение
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: b-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения распространенных при этом заболевании нарушений сердечного ритма используются дизопирамид, амиодарон.
В-адреноблокаторы остаются наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП, что обусловлено в основном способностью этих препаратов уменьшать потребность миокарда в кислороде.
Благодаря отрицательному инотропному действию и уменьшению активации симпато-адреналовой системы при физическом и эмоциональном напряжении b-блокаторы предотвращают возникновение или повышение внутрижелудочкового градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно доказана способность b-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно – за счет уменьшения частоты сердечных сокращений (ЧСС) и предупреждения ишемии сердечной мышцы.
В литературе имеются данные, подтверждающие способность b-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда. Однако вызываемое b-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считает целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями ВС семейным анамнезом.
Предпочтение отдается b-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают, начиная с 20 мг 3–4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой, в большинстве случаев до 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, потому что отсутствие эффекта терапии b-блокаторами связано с недостаточной дозировкой. Повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения кардиоселективных b-блокаторов пролонгированного действия (атенолола, конкора). Существует точка зрения, что кардиоселективные b-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, потому что в больших дозах селективность утрачивается. Рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных b-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимального профиля фармакологических свойств препаратом выбора является верапамил (изоптин, финоптин).
Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению b-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую и улучшать его диастолическое расслабление и податливость ЛЖ. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с b-блокаторами способности к уменьшению внутрижелудочковой обструкции при физическом и эмоциональном напряжении и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия. Однако тяжелые осложнения фармакотерапии верапамилом развиваются у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Отсюда очевидна важность соблюдения осторожности при начале лечения верапамилом этой категории больных.
Назначение препарата следует начинать в условиях стационара с малых доз – 20-40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения ЧСС в покое до 50–60 в минуту. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки, а более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [53].Следует отметить, что b-адреноблокаторы (за исключением соталола) и антагонисты кальция обладают слабой антиаритмической активностью, в то время как частота опасных желудочковых и суправентрикулярных аритмий у больных ГКМП чрезвычайно велика. Поэтому актуально применение у этой категории больных антиаритмических препаратов, в ряду которых наиболее популярным и рекомендуемым ведущими специалистами является дизопирамид.
Дизопирамид (ритмилен), относящийся к антиаритмикам IA класса, обладает выраженным отрицательным инотропным эффектом, у больных ГКМП способен снижать уровень обструкции выходного тракта ЛЖ, положительно влиять на структуру диастолы. Эффективность длительного лечения дизопирамидом доказана в отношении больных ГКМП с умеренной обструкцией оттока из ЛЖ. Особенно выгодно использовать этот препарат у больных с желудочковыми аритмиями. Начальная доза обычно составляет 400 мг в сутки с постепенным увеличением до 800 мг. При этом необходимо контролировать продолжительность интервала QT по ЭКГ. Не менее эффективным средством лечения и профилактики желудочковых, суправентрикулярных аритмий при ГКМП является амиодарон (кордарон), который наряду с антиаритмической активностью несколько уменьшает гиперконтрактильность, ишемию миокарда. Показана его способность предотвращать у больных ГКМП внезапную смерть.
Лечение амиодароном начинают с насыщающих доз (600–1200 мг/сут) в течение 3–7 дней с постепенным, по мере уменьшения частоты ЧСС, снижением до поддерживающей (желательно 200 мг/сут и менее). Учитывая отложение препарата в тканях с возможным нарушением функции щитовидной железы, развитием пневмофиброза, поражения роговицы, кожи и печени, при его длительном (более 10–12 месяцев) приеме необходим регулярный контроль состояния этих «уязвимых» органов с целью раннего выявления возможных осложнении фармакотерапии.
При ГКМП возможны комбинации препаратов, обладающих отрицательным инотропным эффектом: b-блокаторов и антагонистов кальция, b-блокаторов и дизопирамида. Признаки венозного застоя в легких, включая ночные приступы сердечной астмы, при ГКМП не являются редкостью и в большинстве случаев обусловлены диастолической дисфункцией ЛЖ. Таким больным показано лечение b-блокаторами или антагонистами кальция в сочетании с осторожным применением салуретиков. Периферических вазодилататоров и сердечных гликозидов следует избегать из-за опасности ухудшения диастолического наполнения ЛЖ и резкого снижения сердечного выброса.
Мерцание и трепетание предсердий отмечаются у 10–30% больных ГКМП и обусловливают опасность возникновения или усугубления нарушений кардиогемодинамики, возникновение тромбоэмболий, а также повышенный риск развития фибрилляции желудочков. Вследствие этого у больных ГКМП пароксизмальные суправентрикулярные аритмии относят к категории потенциально фатальных, а скорейшее восстановление синусового ритма и предупреждение повторных пароксизмов приобретает особенно важное значение. Для купирования пароксизмов мерцательной аритмии используют антиаритмические препараты IА группы, амиодарон, b-блокаторы, верапамил и дигоксин. В случае их неэффективности проводят электроимпульсную терапию.
При постоянной форме мерцательной аритмии для контроля ЧСС применяют b-блокаторы или верапамил в сочетании с дигоксином. Это единственный случай, когда больным обструктивной ГКМП можно назначать сердечные гликозиды, не опасаясь повышения внутрижелудочкового градиента давления. Поскольку мерцательная аритмия у больных ГКМП связана с высоким риском системных тромбоэмболий, то после ее развития необходимо начинать терапию антикоагулянтами, которые при постоянной форме мерцания предсердий принимают неопределенно долго.
У значительного числа больных ГКМП традиционная фармакотерапия не позволяет эффективно контролировать симптоматику заболевания, а низкое качество жизни не устраивает пациентов. В таких случаях приходится решать вопрос о возможности использования иных, немедикаментозных лечебных подходов. При этом дальнейшая тактика определяется отдельно у больных с обструктивной и необструктивной формами ГКМП. Вопреки распространенному представлению нередко в далекозашедшей стадии патологического процесса (преимущественно при необструктивной форме ГКМП) развивается прогрессирующая систолическая дисфункция и тяжелая СН, ассоциированная с ремоделированием ЛЖ.
Такая эволюция заболевания наблюдается у 2-5% больных ГКМП и характеризует конечную («дилатационную») стадию тяжело и ускоренно протекающего процесса, не зависящего от возраста пациента и давности манифестации болезни. Увеличение систолического размера ЛЖ обычно опережает диастолическое расширение и преобладает над ним. Клиническими особенностями этой стадии являются выраженная, нередко рефрактерная застойная СН и исключительно плохой прогноз. Лечебная стратегия в отношении таких больных меняется и строится на общих принципах терапии застойной СН, предусматривает осторожное назначение иАПФ, блокаторов рецепторов ангиотензина II, диуретиков, сердечных гликозидов, b-блокаторов и спиронолактона. Эти пациенты являются потенциальными кандидатами для проведения трансплантации сердца.
Хирургическое лечение
При отсутствии клинического эффекта от адекватной медикаментозной терапии больным с III–IV ФК NYHA и выраженной асимметричной гипертрофией МЖП, субаортальным градиентом давления равным 50 мм. рт. ст. и более, показано хирургическое лечение. Классическая методика – это чрезаортальная септальная миэктомия, предложенная A.G. Morrow (1988). У больных молодого возраста с семейным анамнезом ГКМП с тяжелыми клиническими проявлениями, указанием на раннюю внезапную смерть у родственников показания должны быть расширены. В некоторых кардиохирургических центрах Европы и США она проводится также в случаях значительной латентной обструкции. В целом потенциальными кандидатами для проведения оперативного лечения являются не менее 5% из числа всех больных ГКМП.
Операция обеспечивает хороший симптоматический эффект с полным устранением или значительным уменьшением внутрижелудочкового градиента давления у 95% больных и значительным снижением конечно-диастолического давления в ЛЖ большинства больных. Хирургическая летальность в настоящее время значительно снизилась и составляет около 1–2%, что сопоставимо с ежегодной летальностью при медикаментозной терапии (2–5%). Хотя в большинстве случаев более ранних исследований не удавалось обнаружить существенного влияния хирургического лечения ГКМП на прогноз, тем не менее С. Seiler et al. (1989) показали улучшение 10-летней выживаемости оперированных больных до 84% по сравнению с 67% в группе лечившихся медикаментозно.
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты операции позволяет последующая длительная терапия верапамилом, как обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
В настоящее время разработаны и успешно применяются методики, отличные от классической трансаортальной септальной миэктомии. В частности, в НЦССХ имени А.Н. Бакулева под руководством академика РАН и РАМН Л.А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части ПЖ. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
В последние годы растущий интерес вызывает изучение возможности использования в качестве альтернативы хирургическому лечению больных обструктивной ГКМП последовательной двухкамерной электрокардиостимуляции с укороченной атрио-вентрикулярной задержкой. Вызываемое этим изменение последовательности распространения волны возбуждения и сокращения желудочков охватывает вначале верхушку, а затем МЖП, приводит к уменьшению субаортального градиента благодаря снижению регионарной сократимости МЖП и расширению выносящего тракта ЛЖ.
Важное значение имеет подбор наименьшей величины времени задержки нанесения желудочкового импульса после предсердного, которая обеспечивает преждевременную деполяризацию верхушки сердца, не приводя при этом к ухудшению кардиогемодинамики – снижению сердечного выброса и АД. Для этого в ряде случаев приходится прибегать к удлинению времени спонтанной атрио-вентрикулярной проводимости с помощью терапии b-блокаторами или верапамилом, иногда используют аблацию атрио-вентрикулярного узла.
Хотя первые неконтролируемые наблюдения были обнадеживающими, более поздние рандомизированные исследования показали, что достигаемые при такой электрокардиостимуляции симптоматический эффект и снижение субаортального градиента давления относительно невелики (около 25%), а существенные изменения физической работоспособности отсутствуют. Не удалось обнаружить и существенного влияния электрокардиостимуляции на частоту внезапной смерти. Поэтоиу до уточнения роли электрокардиостимуляции в лечении обструктивной ГКМП расширенное клиническое применение этого метода не рекомендуется.
Другим альтернативным методом лечения рефрактерной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающий от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматики заболевания. При этом в 5–10% случаев возникает необходимость имплантации постоянного электрокардиостимулятора в связи с развитием атрио-вентрикулярной блокады высокой степени.
В настоящее время не доказано положительное влияние транскатетерной аблации на прогноз, а операционная смертность (1–2%) не отличается от таковой при проведении операции септальной миэктомии, считающейся на сегодняшний день «золотым стандартом» лечения больных ГКМП с выраженной симптоматикой и обструкцией выходного тракта ЛЖ, резистентных к фармакотерапии.
В запущенных случаях (при развитии митрализации порока, значительном снижении ФВ и формировании ХСН IV ФК, сопутствующем кальцинозе АК и стенки аорты) радикальная операция становится очень рискованной. В этих случаях лучше ограничиться наложением клапансодержащего шунта между верхушкой ЛЖ и аортой, называемого апико-аортальным.
Эту операцию впервые разработал и осуществил Denton Cooly в 1975 году. Он выполнял ее с искусственным кровообращением, вводя через разрез верхушки в полость ЛЖ жесткий наконечник, переходящий в клапансодержащий дакроновый шунт, имплантируемый в нисходящую аорту. В ходе операции создавался второй выход из ЛЖ и градиент на выходе из аорты уменьшался или исчезал. Отягчающим моментом в этой методике было искусственное кровообращение, которое мы исключили, разработав свой способ операции (В.П. Поляков, В.В. Горячев, А.В.Поляков, 1998).
Для этого мы разделили шунт на 2 бранши. Одна бранша из левостороннего бокового доступа в 6 межреберье анастомозировалась с нисходящей аортой над диафрагмой и пережималась. Вторая бранша оканчивалась подшитым к ней мягким тефлоновым кольцом. За это кольцо П-образными швами на прокладках шунт прочно фиксировался к бессосудистому участку верхушки ЛЖ. Затем специально разработанным резектором, введенным в просвет этой бранши, иссекался и удалялся вместе с резектором участок стенки ЛЖ (соответствующий внутреннему просвету бранши). Длина шунта рассчитывалась нами визуально. Между браншами накладывался анастомоз с фиксацией в нем дискового протеза клапана.
После снятия зажимов анастомоз начинал функционировать и сразу же градиент давления в выходном отделе резко снижался или исчезал вовсе. Таким способом в 90-х годах 20-го столетия нами прооперировано 22 больных ГКМП с ХСН III-IV ФК. Летальность в течение 10 лет наблюдения не превышала 9%. Все больные получали антикоагулянтную терапию, с нарушениями которой были связаны тромбозы шунтов у двух пациентов в течение первых 3-5 лет.
Таким образом, лечебная тактика при ГКМП достаточно сложна и предполагает индивидуальный анализ всего комплекса клинических, анамнестических, гемодинамических показателей, результатов генной диагностики и стратификации риска внезапной смерти, оценку особенностей течения заболевания и эффективности используемых вариантов лечения. В целом рациональная фармакотерапия в сочетании с хирургическим лечением и электрокардиотерапией позволяют получить хороший клинический эффект, предупредить возникновение тяжелых осложнений и улучшить прогноз у значительной части больных гипертрофической кардиомиопатией.
К каким докторам следует обращаться если у Вас Гипертрофическая кирдиомиопатия:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Гипертрофической кардиомиопатии, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Источник

